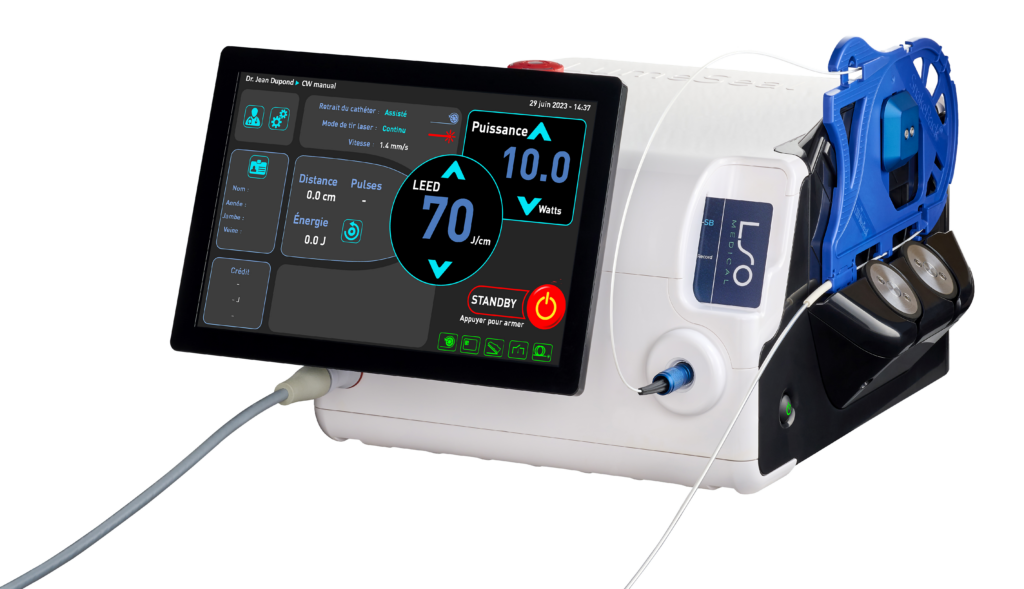
El láser endovenoso de 1470 nm para la ablación térmica de las varices
- La oclusión de la vena safena mayor.
- La oclusión de la vena safena menor.
Características principales y accesorios compatibles
- Diseñado con la tecnología SnakeBack®.
- Compatible con la fibra radial Ringlight_SB®.
- Automonitoreo en tiempo real del láser y de la fibra gracias al sistema BackReflection™.
Tras el éxito del Pharaon 980 nm y la validación del interés clínico de la longitud de onda de 1470 nm (Endotherme™ 1470), LSO Medical integra un diodo de 1470 nm (infrarrojo) en su nuevo láser LumeSeal®.
Esta longitud de onda de 1470 nm, combinada con su modo de disparo “continuo”, está hoy reconocida como el Gold Standard en el tratamiento de ablación térmica de las safenas mediante láser.
Para más información sobre el interés de la longitud de onda de 1470 nm, véase el estudio de Doganci:
Desde 2012, LSO Medical ofrece una gama completa de fibras radiales Ringlight®.
Para mayor flexibilidad, las fibras radiales Ringlight® están disponibles en 3 tamaños:
- Estándar 1,8 mm, 600 µm (+ opción Fused disponible)
- Slim Fused 1,3 mm, 400 µm
- Slim 1,0 mm, 400 µm
Para garantizar la compatibilidad con la tecnología SnakeBack®, existen las fibras Ringlight_SB®. Estas integran todos los elementos de la tecnología «SnakeBack®».
Para más información sobre el interés de las fibras radiales, véase el estudio de Doganci:
- Una configuración sencilla para un mejor control del procedimiento.
- Un control del retiro asistido / automatizado de la fibra gestionado únicamente desde la interfaz de usuario.
El SnakeBack® es un sistema de retiro asistido sin tensión, capaz de planificar, aplicar y controlar la administración de energía en la vena.
El LumeSeal® permite así una entrega de energía perfecta a lo largo de toda la vena, manteniendo una regularidad de tratamiento impecable.
Una trazabilidad completa para cada procedimiento:
- El LumeSeal® permite una trazabilidad de cada procedimiento gracias a la presencia de una tarjeta con chip entregada con cada fibra láser de disparo radial SB.
- Láser: Láser de diodo
- Longitud de onda: 1470 nm
- Clase Láser: 4
- Clase DM: IIb (Directiva 93/42/CEE y Reglamento 2017/745/UE)
- Módulo de retirada: SnakeBack®
| Denominación | Referencia | Especificaciones técnicas | Compatibilidades |
|---|---|---|---|
| RINGLIGHT® FIBER PROBE IR_SB 1,8 mm | ORLF000003_SB | Fibra Ringlight_SB® Estándar 600 µm, 1,8 mm | Láser: LumeSeal® Introductor: Introductor 6 Fr |
| RINGLIGHT® FIBER PROBE IRH_SB 1,0 mm | ORLF000005_SB | Fibra Ringlight_SB® Slim 400 µm, 1,0 mm | Láser: LumeSeal® Introductor: Introductor 4 Fr o Cathlon 16G |
| RINGLIGHT® FIBER PROBE IR_SB 1,8 mm | ORLF000006_SB | Fibra Ringlight_SB® Fused Estándar 600 µm, 1,8 mm | Láser: LumeSeal® Introductor: Introductor 6 Fr |
| RINGLIGHT® FIBER PROBE IRH_SB 1,3 mm | ORLF000007_SB | Fibra Ringlight_SB® Fused Slim 400 µm, 1,3 mm | Láser: LumeSeal® Introductor: Introductor 4 Fr o Cathlon 16G |
| Denominación | Referencia | Especificaciones técnicas | Compatibilidades |
|---|---|---|---|
| Carro LumeSeal® | EV2-7-201 | Compatible con LumeSeal_SB® | |
| Gafas para Profesionales | FG1#37 | Lentes azules | |
| Gafas para Pacientes | IRD5#35 | Lentes verdes |
| Denominación | Referencia | Especificaciones técnicas | Compatibilidades |
|---|---|---|---|
| Bomba Dispenser DP 30 – NOUVAG | 4187 |
| Tubería NOUVAG 6022 / 6022a / 6022b |
| Tubería – NOUVAG | 6022 / 6022a / 6022b | Longitud: 4 metros | Bomba Dispenser DP 30 – NOUVAG |
| Kit de ablación térmica vascular 6 Fr – LSO Medical | FR-K66189 | Fibra Ringlight® Estándar | |
| Kit de introducción 6 Fr – SCW | INTRO6F03818GS |
| Fibra Ringlight® Stardard |
Destinado a: cirujanos vasculares, médicos vasculares, farmacéuticos, ingenieros biomédicos y personal de quirófano
Equipo médico láser:Endotherme™ y LumeSeal_SB®. Clase DM: IIb. Clase Láser: 4 (uso obligatorio de gafas de protección)
Equipo consumible estéril: Ringlight® y Ringlight_SB®, Clase DM: IIa
![]() 1639
1639
Consumibles Láser:Las fibras Ringlight_SB® se venden estériles. Se esterilizan con óxido de etileno. Han sido diseñadas exclusivamente para un solo uso. No pueden reutilizarse ni ser esterilizadas nuevamente.
Indicaciones: Láseres médicos y consumibles estériles para la coagulación endovascular, la oclusión y la ablación de las venas safenas.
Beneficios esperados:Las ventajas del tratamiento con láser endovenoso son: una reducción del tamaño o una obliteración completa de las varices tratadas, y la mejora o incluso la desaparición de los síntomas venosos. El riesgo de complicaciones asociadas a las varices disminuirá considerablemente.
Contraindicación:El LumeSeal_SB® no debe utilizarse en los siguientes casos: Pacientes con trombos en el segmento venoso a tratar, pacientes con aneurisma en el segmento venoso a tratar, pacientes con enfermedades vasculares periféricas con un índice tobillo-brazo inferior a 0,9, pacientes con trombosis venosa profunda o antecedentes de la misma, mujeres embarazadas, pacientes con infección en la zona a tratar, herpes activo u otra infección viral. Otras contraindicaciones pueden ser indicadas por el profesional en el momento del tratamiento.
Efectos adversos:A partir de la literatura analizada, es posible definir tres grandes categorías de efectos adversos para el procedimiento de oclusión de la VSM con láser:
Efectos adversos frecuentes (incidencia < 50 %): hematomas, dolor y trombosis venosa superficial.
Efectos adversos raros (incidencia < 5 % en la mayoría de los estudios): trombosis venosa profunda, parestesias, quemaduras cutáneas.
Efectos adversos excepcionales (menos de 10 casos descritos): parestesia persistente (más de un año) y embolia pulmonar.
Uso de los dispositivos:Formación en el uso del LumeSeal®: por LSO Medical o personas autorizadas por LSO Medical. Lea atentamente las instrucciones del manual de usuario. Para que el sistema cumpla con los requisitos definidos, se debe realizar una calibración del dispositivo al menos una vez al año. Esta calibración debe ser realizada por un técnico autorizado por LSO Medical o por su distribuidor local autorizado.
Tratamiento endovenoso con láser: Cubierto por el seguro de salud
Fabricante de dispositivos médicos
LSO Medical – Biocentre A. Fleming, Edificio D – 280 rue Salvador Allende – 59120 Loos, Francia
Fabricante del sistema y del material necesario
Distribuidor e importador de los productos: SCW, NOUVAG
Limpieza de la carcasa plástica y pantalla táctil: paños húmedos y detergente desinfectante conforme a las Normas Microbiológicas Europeas: Bactericida (EN 1040), Bactericida en condiciones sucias (EN 1276), Activo contra Aspergillus fumigatus y activo contra Mycobacterium tuberculosis, Fungicida (EN 1275), Activo contra HIV-1, HBV, Rotavirus, virus del herpes y BVDV (sustituto del VHC).
Desecho:El LumeSeal® contiene elementos que requieren un reciclaje específico. El producto puede ser recogido por el fabricante o por cualquier organismo competente.
Referencia interna: 23/04/LSOMEDICAL/PM/001
Materialovigilancia: Todo incidente grave relacionado con el dispositivo debe ser notificado al fabricante y a la autoridad competente del Estado miembro en el que esté establecido el usuario o el paciente.
Versión: IM EMB – VA-fr – Avril 2023


